
電解廢液真是環保的元兇?
國中組 第一名
縣 市:基隆市
校 名:中正國中
作 者:林佑竹、蔡亞純
許慶霖、高晨育
指導教師:劉燕孝、徐增錦

許慶霖:巨蟹座。興趣:聽音樂、上網、看雜誌、看課外讀物。有幸能夠參與這次全國科展,我倍感殊榮,希望我們將來一樣能有如此不錯的成績,以我們所學,造福社會大眾。
林祐竹:摩羯座。我平常喜歡聽聽音樂、看看有關科學的書籍。這次我非常非常高興,也很榮幸參加這次科展,雖整個過程艱辛,有時一天花費16個小時在做實驗,但我真的學到a lot of things。也非常感謝教導我們的老師囉!
蔡亞純,處女座。興趣是閱讀、聽音樂、吃喝玩樂、因為崇拜手治虫,所以立志當外科醫生。愛因斯坦說過成功是工作加上娛樂和閉嘴不說話,所以目前自己正以這個目標修身養性中。
高晨育,巨蟹座。我的興趣是從事理化科研究,並從中獲得樂趣,我也從科展中獲得許多待人處事的方法,也結交了許多知
關鍵詞:電解硫酸銅、實驗室廢水處理
一、研究動機
(一)從報紙上得知,電鍍工廠排放廢液造成大量環境污染。
(二)我們在學校實驗室完成電解(實驗13-4)、電鍍(13-6演示實驗)甚至鋅銅電池(實驗14-1)等實驗之後所剩下的廢液如果直接排放,是不是同樣也會造成環境的污染呢?
(三)電解廢液不應該只是破壞環境的元兇,其實電解法本身應該也是解決電解廢液問題的答案才對。因此我們計劃將實驗室中現有的電解、電鍍設備加以做簡單化、安全化之改良並與其他方法結合,尋求其處理之最適條件。以此改良之電解方式不但可以達成降低廢液濃度到環保排放標準的主要目的,同時更可以將其中的重金屬成分回收作再利用;而且乾淨、迅速,不會造成二次的污染。
二、研究目的
(一)直接電解硫酸銅溶液最適條件之探討
針對課本電解硫酸銅實驗進行分析,探討以直接電解硫酸銅廢液回收處理時,可獲得最大回收率及最佳回收品質之各種有關電極、電源及廢液條件之變因。
(二)開發出新式二階段廢水處理技術
1.利用光電比色計測量各已知濃度之硫酸銅溶液的吸光值,並製作出吸光值與濃度間相關之回歸函數。
2.探討化學沉澱法處理實驗室電解硫酸銅廢液之最適條件。
3.綜合「化學沉澱」與「直接電解」二法,並配合於電解槽兩極間設置半透膜、調整沉澱槽及廢液槽適當之酸鹼度及嘗試以多電極之安排等條件之探討以達成最佳之回收效果。
(三)彙整與比較
彙整目前常見之各種電解廢水處理方法、分析其原理及優缺點,並與本法作比較。
三、研究設備
(一)藥品:CuSO4、銅片、碳棒、硫酸、氫氧化鉀、去離子水。
(二)器材
玻璃器材:滴管、量筒、燒杯、攪拌棒、集氣用水槽、溫度計、石英管、電解槽。
電子器材:pH計、可攪拌式加熱板、光電比色計、原子吸收光譜儀、吹風 機(冷、熱風)、電子秤、電腦及周邊設備、電源供應器、安培計。
其 他:自製恆溫電解槽(透明塑膠水槽、玻璃紙、保麗龍、直流電源器、水族箱恆溫控制器、溫度計)、自製布袋蓮吸收過濾廢水處理槽、鱷魚夾、導線、尺、刮勺、玻璃紙,秤量紙、碼錶、定時器、砂紙、拭鏡紙、濾光片。
四、研究過程
(一)直接電解硫酸銅溶液最適條件之探討
1.將一長方形的保利龍盒(17cmx20cmx10cm),裡面鋪上 鋁箔紙後用膠帶黏住,將另一塊保利龍裁成蓋子在上面切割一個長10公分寬12公分的洞口,來放置電解槽,電解槽為一1000mL之燒杯。
2.以銅片作為負極,碳棒為正極,用兩條鱷魚夾分別夾住並固定在電解槽上,使兩極相距12公分。
3.倒入0.05M硫酸銅溶液1000mL,高11公分,使銅片沒入10公分。
4.利用導線將電源供應器與兩極分別連接並串接一安培計。
5.將隔板置於兩電極間,完全阻隔電極間溶液流通。
6.將硫酸銅溶液置入電解槽中,開始電解。
7.每隔15分鐘切斷電源取出銅片,並將銅片用冷風吹約3分鐘除去水分並稱其質量並紀錄。
(二)開發新式之二階段電解廢水處理技術
實驗2-1
CuSO4濃度回歸曲線之製作:
步驟:
1.配製0.001M、0.005M、0.008M、0.01M、0.03M、0.05M、 0.08M及0.1M等濃度之CuSO4溶液
2.分別以波長660米m、470米m、420米m及530米m之濾光 片測量0.05M與0.01M之CuSO4溶液之吸光值。
3.選擇最適當之波長作為實驗測量標準,並以此波長測量0.001M、0.005M、0.008M、0.01M、0.03M、0.05M、0.08M及0.1MCuSO4溶液之OD值。
4.將測出之吸光值製作成函數圖形,以電腦求出吸光值對銅離子濃度之相關回歸函數。
實驗2-2
化學沉澱法最適條件探討:
步驟:
1.在200ml的燒杯中,以0.05M的硫酸銅溶液100ml分別與 0.001M、0.01M、0.1M、0.5M及1M的氫氧化鉀溶液100ml配出pH值分別為10、11、12、12.5及13的溶液各共200ml,並測量氫氧化銅沉澱的高度,加以記錄。
2.根據以上的實驗,找出使等量硫酸銅產生最多氫氧化銅沉澱 之最適之氫氧化鉀的量及pH值(我們將以此條件應用於綜合法當中)。
實驗2-3
電解槽中半透膜的選擇:
步驟:
1.分別以靜電布、玻璃紙、尼龍布、牛皮紙及賽珞芬半透膜作為半透膜之 預備材質,固定於電解槽之中央,使電解槽分隔成陰極槽及陽極槽二部分。
2.陰極槽加入0.05M硫酸銅溶液500ml。
3.陽極槽加入氫氧化銅沉澱300ml與水200ml。
4.根據實驗1-1至1-5所得到之最適電解條件進行電解。每 隔15分鐘更換銅片,並測量銅片增加的質量,加以記錄。
5.經由以上的實驗,找出電解最適的半透膜材質。
實驗2-4
陽極槽pH值之調整以促進氫氧化銅沉澱分解效果之分析:
步驟:
1.玻璃紙作為電解陰陽兩槽間之半透膜,並在陽極槽加入0.05M氫氧化銅沉澱300ml,分別再加1M硫酸5ml、10ml、20ml及40ml,接著電解〈電流1.4A、時間2小時〉,並測量銅片增加的質量,加以記錄。
2.總結以上的實驗,找出電解最適的加酸量及pH值。
實驗2-5
分析同時以多重電極進行電解時提升之回收效果
步驟:
1.以玻璃紙作為電解兩槽間半透膜,並在陽極槽加入氫氧 化銅300ml沉澱,再加1M硫酸20ml與水180ml,接著以一對一、二對二及三對三的陰陽電極電解,並測出所花費的時間,加以記錄。
2.歸結以上的實驗,找出電解最適的電極數。
實驗2-6
三種常見水生植物對硫酸銅吸附性之效果比較
步驟:
1廢水吸收處理槽的製作:將容積20L之桶裝礦泉水槽底部鑿一個小洞接上塑膠管,連接至另一塑膠盛水槽。
2在廢水吸收處理槽中加入0.005M﹝相當於電解回收後之廢液濃度﹞之硫酸銅溶液1L,其含金屬銅的濃度為0.3175 g/l。然後分別加入2kg的水蘊草、荷花及布袋蓮。
3經二天後綜合利用光電比色計及原子吸收光譜儀﹝臺大環工所﹞測量其殘餘濃度。
實驗2-7
定量布袋蓮對硫酸銅吸收效果之分析
步驟:
1在廢水吸收處理槽中加入0.005M﹝相當於電解回收後之廢液濃度﹞之硫酸銅溶液1L,其含金屬銅的濃度為0.3175 g/l。加入布袋蓮8kg,經8、16、24、32及40小時後分別取樣並過濾。
2綜合利用光電比色計及原子吸收光譜儀測量其殘餘濃度。
五、常見各種電解廢水處理法之彙整比較
﹝因限於篇幅,故省略﹞
六、 研究結果
﹝因限於篇幅,故省略曲線圖﹞
實驗1-1
探討電流大小與陰極銅離子析出量之關係
結果
最適電流為1.4A。
電流大小(A) |
0.4 |
0.8 |
1.2 |
1.4 |
1.6 |
1.8 |
2 |
增加質量(g) |
0.08 |
0.2 |
0.22 |
0.26 |
0.24 |
0.22 |
0.3 |
實驗1-2
探討陽極直徑大小與陰極銅離子析出量之關係
結果
碳棒直徑0.8公分時析出量最好。
碳棒直徑(cm) |
0.65 |
0.8 |
1 |
增加質量(g) |
0.14 |
0.18 |
0.16 |
實驗1-3
探討陰極總表面積與陰極銅離子析出量之關係
結果
總表面積120cm2時附著量最好
總表面積(cm2) |
30 |
60 |
80 |
120 |
增加質量(g) |
1.2 |
2.35 |
3.55 |
4.8 |
實驗1-4
探討硫酸銅溶液酸鹼值與陰極銅離子析出量之關係
結果
0.01M 30mL的硫酸最適合
PH值 |
3.54 |
2.98 |
1.94 |
0.97 |
增加質量(g) |
0.024 |
0.064 |
0.052 |
0.012 |
實驗1-5
探討電解槽溫度與陰極銅離子析出量之關係
結果
最適溫度為35 。
溫度(攝氏) |
25 |
30 |
35 |
40 |
45 |
50 |
55 |
增加質量(g) |
0.18 |
0.2 |
0.42 |
0.34 |
0.43 |
0.42 |
0.48 |
增加質量(g) |
0.18 |
0.2 |
0.42 |
0.34 |
0.43 |
0.42 |
0.48 |
實驗2-1
CuSO4濃度回歸曲線之製作
結果
吸光值米m |
660 |
530 |
470 |
420 |
0.05M |
22 |
2 |
0.5 |
0.3 |
0.01M |
5 |
1 |
0.25 |
0.2 |
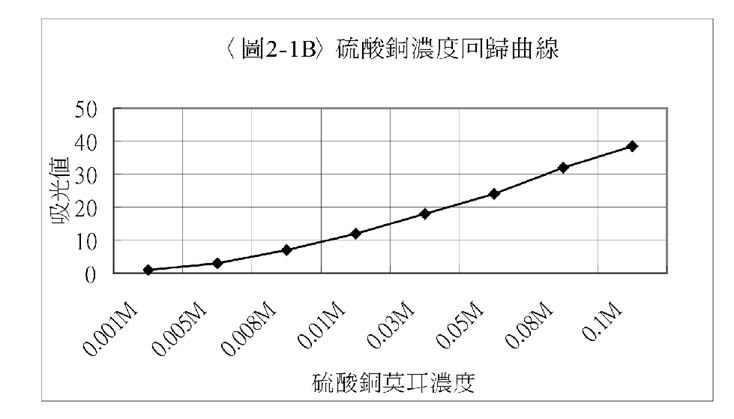
硫酸銅濃度M |
0.001 |
0.005 |
0.008 |
0.01 |
0.03 |
0.05 |
0.08 |
0.1 |
吸光值 |
1 |
3 |
7 |
12 |
18 |
24 |
32 |
38.5 |
實驗2-2
化學沉澱最適比例
結果
pH值達12時可得最多之沉澱量
pH值 |
10 |
11 |
12 |
12.5 |
13 |
氫氧化銅沉澱高度(cm) |
2.1 |
3.8 |
6.3 |
6.1 |
6.2 |
實驗2-3
綜合法最適條件─半透膜的選擇
結果
賽珞芬之回收量最佳,但在實驗經費考量下,故選用效果次佳之玻璃紙。
膜的材質 |
靜電布 |
玻璃紙 |
尼龍布 |
牛皮紙 |
賽珞芬 |
析出銅的質量(克) |
0.171 |
0.540 |
0.074 |
0.121 |
0.862 |
實驗2-4
陽極槽pH值之調整以促進氫氧化銅沉澱分解效果之分析
結果
C槽加硫酸的量 |
1M5mL |
1M10mL |
1M20mL |
1M40mL |
銅析出的質量 |
0.524 |
0.848 |
1.084 |
0.812 |
實驗2-5
分析同時以多重電極進行電解時提升之回收效果
結果
Cu增加的質量 |
15分 |
30分 |
45分 |
60分 |
75分 |
90分 |
105分 |
120分 |
1-1 |
0.29 |
0.61 |
0.94 |
1.34 |
1.64 |
1.99 |
2.27 |
2.64 |
2-2 |
0.59 |
1.1 |
1.93 |
2.6 |
|
|
|
|
3-3 |
0.84 |
1.82 |
2.53 |
|
|
|
|
|
七、討論
(一)直接電解硫酸銅溶液最適條件之探討
1.隨著電流加大,單位時間內陰極得到的電子數較多,故析出的質量會增大,然而1.4A以上的電流雖然析出量增加,但多為黑色的氧化銅附著度很差,所以選擇最適當的電流為1.4A。
2.我們推測碳棒直徑大小可能會影響電流密度,而電流密度則會影響到析出銅的質量。直徑1cm的碳棒因其表面積最大電流密度最小,所以析出量最少。而直徑0.65公分的碳棒,雖然表面積較小電流密度較大,銅的析出量較多;然而其析出的銅多為附著不良的黑色氧化銅,因此大部分的銅均脫落,所以銅片增加量反而不及直徑0.8公分的碳棒,但也有可能為受溶液內電流產生的磁場所影響,還尚需更進一步的探討。
3.在電流密度固定之下,銅片總表面積越大,表面積大銅片可附著面積較大並且約成正比,但因受電解槽大小限制,本實驗以選用(4cmx15cmx0.1cm)尺寸之銅片為最佳。
4.我們加酸的目的除了除去干擾電解的物質之外,我們發現在酸性環境中氧化銅較不易產生;所以我們加酸,使得銅能以較佳的性質析出,不易產生容易脫落的氧化銅,而讓數據有所誤差。此外,電解初期我們觀察到有白色棉絮狀的懸浮物,此種懸浮物之存在極不穩定,經震盪搖晃後即迅速消失,我們推斷可能是亞銅離子或其化合物,根據科學研習月刊第二十八卷第五期報導,亞銅離子可用加食鹽水來加以檢驗,於是我們加食鹽水到硫酸銅溶液中來試驗,結果發現白色棉絮狀的懸浮物的現象變成黃色的沉澱,證實其物質確為氧化亞銅;而我們加酸後同樣發現可以消除氧化亞銅的產生。
5.電解溫度35 以下銅的析出量明顯偏低;用40 以上的溫度電解,發現其銅片增加質量大部分稍高於35 ,那是因為用40 以上的溫度電解,容易產生藍綠色的膠狀物可能為氫氧化銅附在銅片上,而導致銅片的質量增加的緣故。由於氫氧化銅是含水量不定的膠狀物質,且加酸後可被溶解成硫酸銅,其反應式為:Cu(OH)2+H+→Cu+2+H2經實驗後證明確有此溶解現象發生,故可證實此物質確為氫氧化銅。
(二)開發出新式二階段廢水處理技術
1. 當使用530米m、470米 m及420米mm的波長時,因為吸光值數據太小,不易觀察,所以使用波長660米m的濾光片作為測量基準。當濃度逐漸增加時,硫酸銅溶液的吸光值亦逐漸增加。
2. 在pH=12〈硫酸銅水溶液0.05M與氫氧化鉀水溶液0.1M〉的情況下,產生的氫氧化銅沉澱量最多,且在pH>12時,即會產生黑色之懸浮物,所以用pH=12為最適條件。
3. 雖然以賽珞芬做為半透膜的材質所析出的銅最多,且銅的性狀良好,因此我們建議使用賽珞芬作為半透膜;然而,受限於科展經費,我們只好選擇效果次佳的玻璃紙作為膜的材質。
4. 由實驗結果得知加1M硫酸20ml時〈此時pH值為3.2〉,其效果最好。
5. 當我們增加電極數使之成為3對3時,在相同時間內增加了最多的銅,這樣一來便可將電解時間由120分鐘縮短到50分鐘以內,大大的節省處理時間,提升了回收的效率。
6.由以上的實驗結果,將傳統電解、改良式電解二法之硫酸銅電解液殘餘濃度與時間的關係製成綜合圖表如下:
時間〈分〉 |
0 |
15 |
30 |
45 |
50 |
60 |
75 |
90 |
105 |
120 |
傳統電解〈M〉 |
0.05 |
0.046 |
0.04 |
0.036 |
0.033 |
0.03 |
0.027 |
0.025 |
0.023 |
0.021 |
改良電解〈M〉 |
0.05 |
0.04 |
0.02 |
0.015 |
0.005 |
|
|
|
|
|
由上表可知:當我們的廢水濃度需達到排放標準時,使用改良電解法的效果會比傳統直接電解要來的有效率,傳統電解法在電解後,仍離排放標準甚遠且其銅的回收品質、速率都較改良電解法差。當我們採用改良式電解法來處理廢水時,能使其每公升殘留0.768克的銅,更接近環保署排放標準:每一升0.003克。由於聽說水生植物具有過濾及吸收水中雜質的效果,故剩下的廢水依據我們所找的資料推估,當我們採用8kg之布袋蓮來吸收,放置二天後便能夠使殘留的銅將降至0.003g/l以下。
八、結論
(一)直接電解硫酸銅溶液最適條件之探討
1.實驗結果發現硫酸銅溶液濃度0.05M 體積為1000mL時,以35 為反應溫度,加硫酸0.01M 30mL(使pH值達2.98),陰極銅片總表面積達120 cm2,配合陽極碳棒直徑0.8公分、高8.5公分時,聯接直流電流大小1.4A(電流密度為每平方公分24mA)為本電解實驗之最適條件。
2.
課本實驗常見之問題 |
建議解決對策 |
產生白色棉絮狀懸浮物(Cu2O)會讓析出的銅附著不易。 |
調整硫酸銅溶液之pH值使其降至3.0以下。 |
產生藍綠色之氫氧化銅的膠狀物,易附於銅片上,使析出的銅性狀不良。 |
1.調整硫酸銅溶液之pH值使其降至 3.0 以下。 2.調整硫酸銅溶液之溫度達到攝氏35 。 |
產生黑色的氧化銅,性狀不良且容易脫落。 |
1.調整硫酸銅溶液之pH值使其降至3.0以 下。 2.降低電流密度至每平方公分24毫安培。3.降低硫酸銅溶液之濃度至0.05M以下。 |
根據本實驗所獲得之直接電解硫酸銅的最適條件,我們建議針對理 化第三冊課本實驗13-5,其電解液的濃度應降至0.05M以下,同時當我們要處理電解廢液時,都可將電流密度調至每平方公分24毫安培〈其實際電流可依銅片面積大小而加以調整〉而後加酸使其溶液的pH值達至2.98,並將其溫度升高至攝氏35度,這樣一來便可獲得性狀良好紅棕色的銅。
(二)開發出新式二階段廢水處理技術
由以上的實驗結果,將傳統電解、改良式電解二法之銅回收量與時間的關係圖表如下:
時間(分) |
0 |
15 |
30 |
45 |
50 |
60 |
75 |
90 |
105 |
120 |
135 |
傳統電解 |
0 |
0.28 |
0.57 |
0.72 |
0.91 |
1 |
1.23 |
1.41 |
1.52 |
1.76 |
1.83 |
改良電解 |
0 |
0.87 |
1.97 |
2.86 |
3.43 |
|
|
|
|
|
|
(三)各種常見電解廢水處理法之彙整與比較
雖然化學沉積法所處理出的銅有較高的純度,但氫氧化銅卻不易還原再次利用,在廢水直接電解法中,由於溶液銅離子濃度低,因此銅的回收相當困難,本方法即是為改善這兩種方法而設計的,並在兩電極之間加一層半透膜後,就宛如使用溶性陽極來電解,能使陰極室之金屬離子濃度保持一定,並有效的消除干擾物質,而且只需利用實驗室現有器材加以改良,不但兼顧簡便性與時效性,使電解得到高回收率的成果,更解決了實驗室電解廢水所造成環境污染的問題,更可獲得回收率高且性狀良好之銅片。
(四)建議與展望:
本實驗處理電解廢液的裝置乃根據國中課本之電解原理加以應用改良,同學可以在做完電解實驗後,就現有器材立即動手進行廢水處理,不但應用課本知識將環保身體力行,這也證明了電解並非是破壞環境同時也是解決廢液的好方法。
九、參考資料
(一)國中理化第三冊 第十三章第五節 實驗13-4電解硫酸銅 國立編譯館
(二)國中理化第三冊 第十三章 第六節 演示實驗 電鍍 國立編譯館
(三)張世欣、蔡佳宜、黃秀慧 利用電解法探討布袋蓮吸取水中重金屬鹽的能力
(四)許錦文 黃色氧化亞銅是看得見的 第二十八卷 第五期 科學研習月刊
(五)柯清水 化學化工大辭典 正文書局
(六)呂政峰 電鍍學 第十章 廢水處理及資源回收 世一書局
評語
本件以直接電解的方法,探討回收硫酸銅廢液時,如何可獲得最大回收率及最佳品質之電解條件,廢液最後以布袋蓮吸收過濾,研究方法與數據處理甚佳,又富環保觀念,作者對於研究內容相當了解故評給第一名。
回到目錄頁../Index.htm