
氫山氯水環保電解實驗

高中組 第二名
縣 市:台北市
校 名:北一女中
作 者:張玉潔
指導教師:周芳妃
郭春櫻

我是張玉潔,今年十五歲,就讀於北一女中一年級。個性活潑外向,喜歡交朋友、參與各種活動,更喜歡做實驗,並擁有對科學研究的熱誠與執著。本作品「氫山氯水」是針對氯化物的電解實驗,設計了一「創意」且「環保」的電解槽,希望就此電解效應,做更進一步的研究與探討。
關鍵詞:微量電解、氯氣檢驗、氯氣定量
一、研究動機
國中理化課程中,在學習以NaCl(aq)電解時,老師說:「電解濃NaCl(aq)時正極會產生Cl2(g),而電解稀NaCl(aq)卻不會產生Cl2(g),而是電解水產生的O2(g)。」在好奇心的驅使下,便開始著手研究到底這"稀"與"濃"的界線究竟在哪裡呢?然而,大量的Cl2(g)會造成實驗的危險與不便,於是,便想找出一種裝置,以行"微量"且"輕便"的電解。後來看了滴定實驗,引發了以1毫升的滴定吸管製作電解裝置的構想,並以此主題榮獲參加國立科學教育館所主辦的中學生科學專題研究研習營,獲得教授的肯定,認為這個裝置很特殊,不僅有創意而且很符合環保的要件,可以說是''創意環保電解''。得此鼓勵,更加強了研究有關電解的興趣,便開始探討氯化物的電解實驗。
二、研究目的
(一)以''創意環保電解裝置''改良氯化物的電解實驗。
(二)以''創意環保電解裝置''檢測氯化物產生Cl2(g)的最低濃度。
三、實驗器材及藥品
1.燒杯及定量瓶 12.空浣腸盒
2.量筒及攪拌棒 13.各式吸管
3.電源供應器 14.濾紙及石蕊試紙
4.調色盤 15.滴定管
5.9v電池組
16.碼錶
6.鱷魚夾
17.玻璃管
7.鉑電極
18.NaCl(s)
8.KI試紙
19.KI(aq)
9.AB膠及相片膠
20.Na2S2O3(s)
10.電子天秤及秤量紙
21.H2SO4(l)
11.滴管(大3mL、小1mL)
22.去離子水
四、文獻探討
(一)電解食鹽水:
1.電解食鹽水
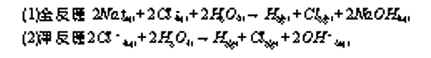
(二)電解產物分析:

 |
 |
 |
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
當然地,滴定終點必須是由式(10)的溶液剛好由藍紫色變成無色穩定液時達成。間接地,正極產生的氯氧含量與碘分子之含量相等。
五、研究過程與方法
(一)傳統簡易電解實驗裝置,空白及改良式試驗
1.開放式(濾紙為鹽橋,空白實驗)

2.開放式(KI試紙為鹽橋,改良式I)

3.開放式(濾紙為鹽橋,正極上串KI試紙,改良式j)
4.半開放式(用吸管集中,, ,改良式k)
5.半開放式(增加,,與KI試紙的接觸面積,改良式l)
6.半開放式(正極外部套上一由細→粗之塑膠滴管,改良式m)
7.半開放式(正極外部套上一由粗→細之塑膠滴管,改良式n)
8.半開放式(吸管上疊五層之KI試紙,改良式o)
9.半開放式(上疊KI試紙由5張→10張,改良式p)
10.密閉式(以小滴管粗細交接處為電解漕,改良式q)
11.密閉式(以大滴管粗細交接處為電解槽,改良式r)
12.密閉式(以小滴管滴頭部份為電解槽,改良式s)
13.密閉式(以大滴管滴頭部份為電解槽,改良t)
14.密閉式(以空浣腸盒為電解槽,改良rk)
(二)以環保電解裝置檢測氯化物產生Cl2(g)的最低濃度
1.電解產生的最低濃度(定性實驗,電解槽:1.0mL)
2.定量實驗(以0.001M 滴定)
(1)不剪斷小滴管之滴頭,而將管子前端稍用火烤待他軟化時彎曲。
(2)在滴管左右兩側插入電極,如同小滴管滴頭電解槽。
(3)準備一個小玻璃瓶,內裝入20mL配置好的0.2M KI及澱粉液數滴。
(4)將小滴管套進瓶內,通入9V電流開始電解,如圖。

(5)電解後以0.001M的滴定,至藍紫色液體澄清透明為止。
(6)記錄使用前後之刻度,並計算其用量。
3.電解時間與產量的關係
(1)取數組不同的電解時間
4.改變氯鹽的種類
(1)改由1M的電解。
5.定溫下濃度對電解的影響
(1)定溫在20 。電解1,0.1,0.01,和0.001M的NaCl(aq)。
6.定溫下濃度對電解的影響
(1)定溫在20 。電解1,0.1,0.01,和0.001M的KCl(aq)。
7.不同濃度對電解1M 的影響
(1)分別將恆溫槽內定溫在20 與40 。
8.不同濃度對電解1M 的影響
(1)分別將恆溫槽內定溫在20 與40 。
六、實驗結果
(一)傳統簡易電解實驗裝置,空白及改良式試驗









綜合上述實驗其不同方式的優劣比較如下表所示
|
開放式 |
半開放式 |
密閉式 |
優點 |
|
1.可集中Cl2,不產生過量Cl2→較安全。 |
1.微量電解,產生少量→安全性佳,具環保性。 |
缺點 |
1.不易發現是否己產生Cl2。 |
1.電解液多,裝置複雜。 |
|
大滴頭、小滴頭及空浣腸盒電解槽的比較。
|
大滴頭 |
小滴頭 |
空浣腸 |
優點 |
反應明顯 |
1.靈敏度高 |
|
缺點 |
不夠靈敏 |
|
1.電解液多,產生 過量。 |
基於上述比較,以下定性,定量實驗皆以小滴頭為電解槽。
(二)以環保電解裝置檢測氯化物產生Cl2(g) 的最低濃度
1.電解時間Cl2(g)產量的關係
不同濃度之的電解時間與用量(mL)的關係。
2.改變氯鹽的種類
在20 下,濃度1M的與的電解時間與用量(ml)
的關係
3.定溫下濃度對電解的影響
在20 下,不同濃度的的電解時間與用量(ml)的關係
4.定溫下濃度對電解的影響
在20 下,不同濃度的的電解時間與用量(ml)的關係
5.不同濃度對電解1M 的影響
不同溫度下,1M的的電解時間與用量(ml)的關係
6.不同濃度對電解1M 的影響
不同溫度下,1M的的電解時間與用量(ml)的關係
(三)以環保電解裝置檢測不同氯鹽之產生Cl2(g)之最低濃度
與Cl2(g)最終產量
1.[] = 0.01 M,1.0 mL不同氯鹽的電解時間與用量(mL)的關係
→:表示理論上最大產量之0.001M 用量
2.[] = 0.001 M,1.0 mL不同氯鹽的電解時間與用量(mL)的關 係
3.[] = 0.01 M,1.0 mL不同氯鹽在1.0 M 的電解時間與 用量(mL)的關係
七、討論
(一)傳統簡易電解實驗裝置,空白及改良式試驗以下定性,定量實驗皆以小滴頭為電解槽。
(二)以環保電解裝置檢測不同氯鹽之產生,,之最低濃度與,,最終產量
1.電解不同氯鹽產生之最低濃度大部分氯鹽在電解時,產生之最低濃度大約在0.001M~0.01M左右。但是電解,,+與,,+氯鹽時,其用量超過理論上氯鹽溶液電解生成最大產量之用量。
2.電解0.01M不同氯鹽產物之最終用量不同氯鹽產物之最終用量會隨著陽離子種類改變而有所不同,比較它們大小順序,歸納如下:
(1)八種陽離子順序為:,,+,,,,,,,,,,,,k,,,,。
(2)負極上有析出金屬之陽離子順序為:,,+,,,,,,,+,,,,+ 。
(3)負極上沒有析出金屬之2+陽離子順序為: ,,+,,+,,。
(4)負極上沒有析出金屬之1+陽離子順序為: ,+,Na。
a.過量電壓的效應:
由計算值結果推測施加過量電壓(忖Ee)大小順序,與實驗所得之電解不同陽離子氯鹽產物之最終用量順序做比較,推測施加過量電壓大小順序與可能是影響負極上有析出金屬之陽離子氯鹽產生最終產量的因素之一。
b.氯鹽水溶液中的陽離子電荷密度效應:
陽離子半徑(r)大小順序,與實驗所得之電解不同陽離子氯鹽產物之最終用量順序做比較,陽離子正電荷密度大小順序只與負極上沒有析出金屬之陽離子,k,Na,氯鹽之最終用量順序有相關性,但是對兩類的陽離子氯鹽之最終用量順序均無關。所以,陽離子的正電荷密度大小可能不是影響陽離子氯鹽電解產生最終產量的主要因素。
c.100倍的電解質溶液中,水在正極上伴生氧化反應效應:
因此為了排除討論b陽離子電荷密度效應與確認本討論c之水的氧化反應效應,因此設計在原有的氯鹽溶液中添加濃度高於氯鹽100倍的,重新進行電解實驗。將負極上沒有析出金屬之氯鹽結果整理如下:
負極上沒有析出金屬之0.01 M氯鹽電解產物之最終用量(mL)
X:氯鹽在水中
Y:氯鹽在1.0 M 中
Z:Y值-不含氯鹽之1.0 M 電解產物之最終用量
|
不含氯鹽 |
|
|
|
|
|
X(mL) |
0.0 |
4.0 |
5.5 |
10.2 |
8.1 |
(21.3) |
Y(mL) |
2.1 |
3.0 |
3.0 |
3.0 |
3.2 |
8.0 |
Z(mL) |
0.0 |
0.9 |
0.9 |
0.9 |
1.1 |
5.9 |
(X-Z) |
0.0 |
3.1 |
4.6 |
9.3 |
7.0 |
15.4 |
註:( )表示用量超過10.0 理論上=,1.0mL氯鹽溶液電解生成最大產量之0.001M 用量為10.0 mL。
若假設氯鹽在水中與在1.0 M 之電解產生之最終產量相同,則推測表(B)內的(X-Z)值表示電解氯鹽時正極上水氧化生成的最終產量,則的最終產量會隨著陽離子種類改變而不同。在此假設中,電解氯鹽在水中的的最終產量高於在1.0 M 中。
八、結論
1.傳統的簡易電解裝置是以開放式的調色盤來做,然而其裝置不僅在操作過程中有許多不便之處(見討論1及討論15) ,更是有安全性不足的缺點,尤其在教學時眾多學生齊聚教室,產生大量的 ,不但危險度高,也造成了環境的污染於是,為了找出新的電解槽,開始由調色盤著手,漸次地以不同容器將集中,並且朝著微量的目標前進,而經由開放 → 半開放 → 密閉的探討後,終於找出既“微量”“輕巧”而又“靈敏度高”的電解槽!並且進一步將其延伸改變為可做定量分析的實驗裝置。
2.以環保電解裝置檢測不同氯鹽之產生之最低濃度,發現大部分氯鹽在電解時,產生之最低濃度大約在0.001M-0.01M左右。而藉由這個“小小的”“環保電解”,竟可測出這些十分稀釋的濃度。可見此“環保電解”裝置的靈敏度確實較“簡易電解”調色盤裝置的實用性及技術性進步很大呢!
3.氯鹽水溶液電解產物之最終用量高於在1.0 M 電解產物。
4.本實驗歸納出施加過量電壓及水的正極氧化反應可能都是影響最終用量的因素,但尚有一些因素未考慮,例如離子在水中的遷移速度、電解反應中產生的與的濃度與其電荷密度等因素。雖然如此,本實驗確實歸納發現影響不同氯鹽電解產生最終產量之主要因素有所不同。
九、參考資料
1.高源清,"牛頓化學辭典" ,牛頓出版股份有限公司,第193頁,993年出版。
2.鄭勇武,"新標準高中高成就化學(二)" ,興建圖書企業有限公司,第361-376 頁,1990年出版。
3.萬其超,"電化學" ,第2-33頁,台灣商務印書館,1978年出版。
4.謝淵清,"電化學反應方程式" ,徐氏基金會,第7~20頁,1982年出版。
5.鄭華生,"基礎化學實驗-容量分析" ,歐亞書局,212~226 頁1984年出版。
評語
具有創新力,以簡易滴管,設計出微小電解槽,是本實驗得獎之主要原因,而且應用於電解氯化物效果相當不錯,在環保觀念二也確實落實在電解槽之設計。
十、衷心地致謝
1.感謝林宜賢、胡立志同學在電腦繪圖技術上的協助。
2.感謝紫玲的爸爸協助攝影工作。
3.感謝爸爸、媽媽長久以來的鼓勵與支持。
回到目錄頁../Index.htm